文章链接:https://doi.org/10.1021/acs.jpclett.2c02272
多柔比星(DOX)是最有效的一种天然蒽环类抗癌药物,临床上常用于乳腺癌,肺癌,卵巢癌等多种癌症的化疗。目前,多种DOX的药物递送系统已被开发以提高其疗效和安全性。对于脂质体、胶束、聚合物等高生物安全性的材料,其往往存在操作复杂,药物负载率低等缺点;而无机材料,如介孔硅、碳纳米管、金属有机框架等尽管拥有理想的药物负载效率,但生物毒性问题限制其临床转化。纳米黏土用作矿物药已有几千年的历史,其具备生物相容性好,表面羟基丰富,高负载能力等优势。尽管黏土矿物在DOX的递送方面已见报导,然而天然黏土矿物与DOX的结合及释放机制尚不清楚。
文章要点
要点一:纳米黏土的形貌及结构表征
首先,通过X射线电子衍射(XRD)及透射电子显微镜(TEM)对三种最常用的医用黏土矿物(埃洛石(HNTs),高岭石(Kaol)和蒙脱石(MMT))的形貌及结构进行表征,进一步地,通过原子力显微镜(AFM)表征材料的形貌结构及表面粗糙度(Rq)(图1)。相比Kaol和MMT,HNTs具有较高的Rq,这可能与其管状形貌有关。而Kaol和MMT的片状形貌使其表面更加平滑。

图1 纳米黏土的表征:(a)XRD图,(b)TEM图(插图:FFT图),(c)HRTEM图,(d)AFM的形貌图及(e)表面粗糙度。
要点二:DOX负载的纳米黏土的制备与表征
通过溶剂浸渍法制备了DOX负载的纳米黏土(图2a)。从外观看,负载DOX后,白色的纳米黏土呈现出红色外观,这证实了DOX的成功负载(图2b),且DOX的负载率和封装率分别在50%和90%左右(图2c,d)。从表面电位看,DOX呈现出带正电,纳米黏土与DOX结合后,其带电性质由负变正(图2e)。傅里叶变换红外光谱(FTIR)反映出DOX负载的纳米黏土具有与DOX相同的特征峰。X射线光电子能谱(XPS)分析证实了这三种纳米黏土对DOX的成功负载,同时,DOX的电子转移到纳米黏土表面。
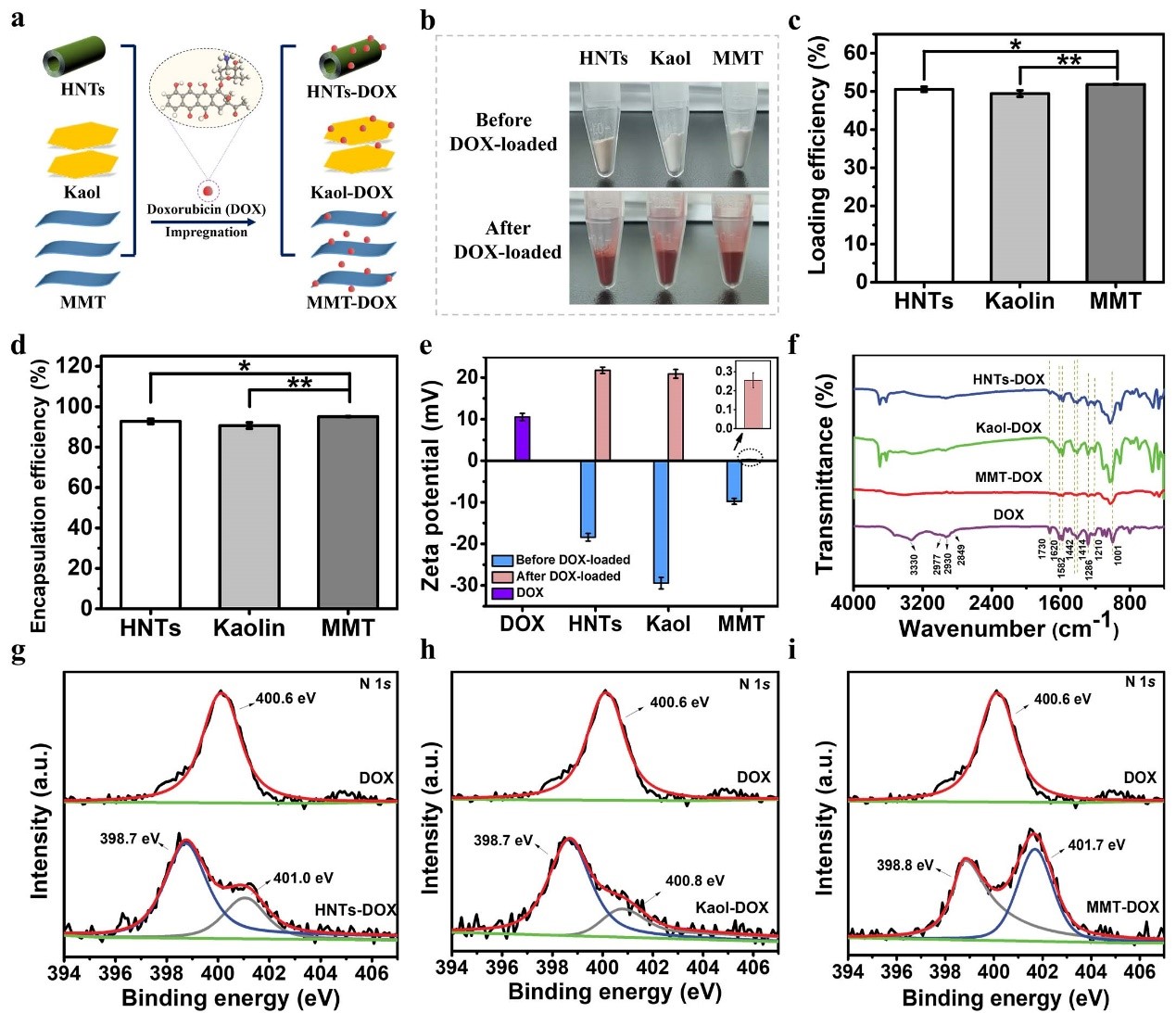
图2(a)纳米黏土负载DOX的示意图,(b)纳米黏土负载DOX前后的光学图像, 纳米黏土对DOX的(c)负载率和(d)封装率,(e)Zeta电位,(f)DOX、纳米黏土负载DOX前后的的FTIR图,N 1s高分辨率XPS图:(g)HNTs-DOX,(h)HNTs-DOX和(i)MMT-DOX。
要点三:纳米黏土的药物负载机制
图3a是管状HNTs、片状Kaol和MMT的结构示意图。表面自由能和界面相互作用能的计算可为DOX的负载提供理论依据。图3b~d可以看出,蒙脱土表现出更高的界面相互作用自由能,MMT表面形成了更厚更牢固的水化膜,其亲水性增强。图3e~g显示了Lewis分量在纳米黏土表面自由能中的占比(约56%)。纳米黏土表面的路易斯碱(Si-O)有助于稳定DOX,从而促进药物的理想负载。
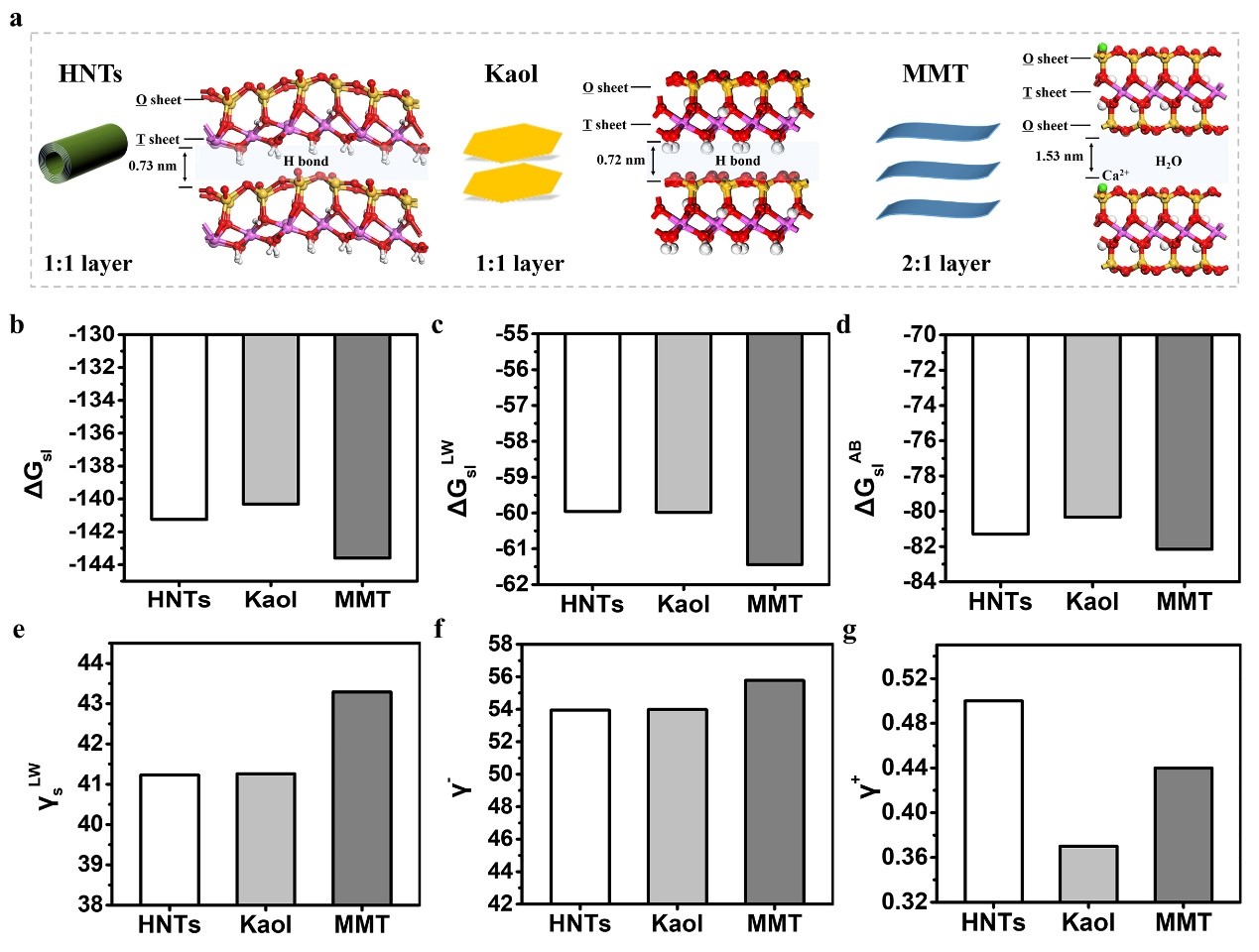
图3(a)三种纳米黏土的结构示意,(b)三种纳米黏土的总界面相互作用自由能,(c)Lifshitz-van der
Waals分量,(d)Lewis分量,(e)Lifshitz-van der
Waals分量,(f)Lewis碱分量,(g)Lewis酸分量,mJ/m2。
其次,利用密度泛函理论(DFT)计算DOX在纳米黏土表面的吸附能,分析吸附机理(考虑到HNTs的管状结构对于DFT分析中模型的构建难度,且HNTs与Kaol同为1:1层状结构,因此,以Kaol的计算结果作为参考)。图4a表明,DOX优先吸附在Kaol的Al-OH表面(吸附能为-3.73 eV),而在Si-O表面发生有限的吸附(吸附能为-2.38 eV)。由图4b可知,DOX可吸附在MMT的Si-O平面上(吸附能为-2.72 eV)。这些结果表明,DOX与Kaol的结合比MMT更紧密。这种实验与理论相结合的研究方法可以推广到其他药物分子与纳米黏土的作用机制的研究中。
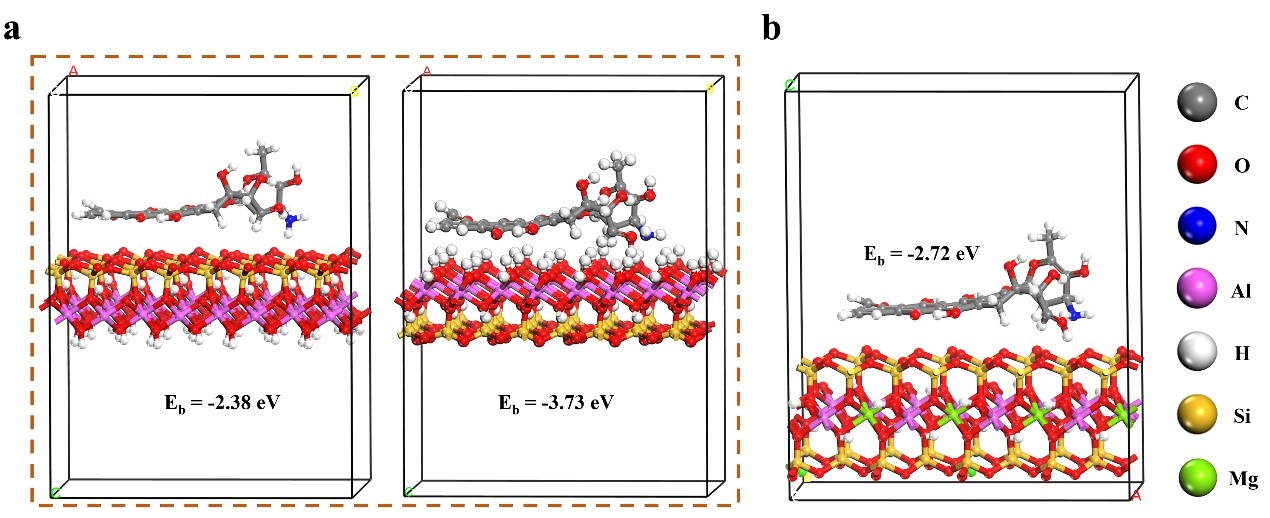
图4 DOX在(a)高岭石团簇上通过硅氧烷位点(左)和Al-OH基团(右)的表面吸附和在(b)蒙脱土团簇上通过硅氧烷位点的的表面吸附。
要点四:纳米黏土的药物释放机制
结合正常生理环境(pH = 7.4)和肿瘤微环境(pH = 5.0 ~ 7.4)的差异,模拟DOX在不同环境下的释药行为。图5a~c表明,DOX负载的纳米黏土具有pH响应性的药物释放行为,这与带负电荷的纳米黏土在弱酸性溶液中的质子化作用有关。进一步地,使用Higuchi模型和Peppas模型来研究其释放机制(图5d~f)。由于DOX负载的纳米黏土中存在静电相互作用(弱化学吸附)和氢键(物理吸附),因此,纳米黏土存在对DOX的快速释放及稳定缓释的过程。对于MMT,释放速率的降低是由于DOX在其层间的吸附。纳米黏土对肿瘤微环境的响应使其成为抗癌药物的智能载体(图5g)。
图5h表明纳米黏土在72 h内对HT-29细胞几乎没有细胞毒性。图5i证实了DOX负载的纳米黏土对肿瘤细胞的抑制效果。虽然HNTs和Kaol的药物负载率相当,但Kaol对DOX具有更好的药物释放效果,从而抑瘤效果更佳。对于MMT,其层间距越大,DOX的释放越容易。且层间距增大使更多带负电荷的Si-OH暴露在MMT表面,有利于DOX分子的释放行为,从而降低毒性,提高DOX在该给药系统中的效率。除了DOX和纳米黏土之间的相互作用外,由于纳米黏土必须通过内吞作用进入癌细胞,因此可以通过细胞内吞过程减慢DOX的释放速度。这一结果表明,纳米黏土不仅可以作为良好的药物载体,而且可以通过持续的药物释放增强肿瘤抑制作用。
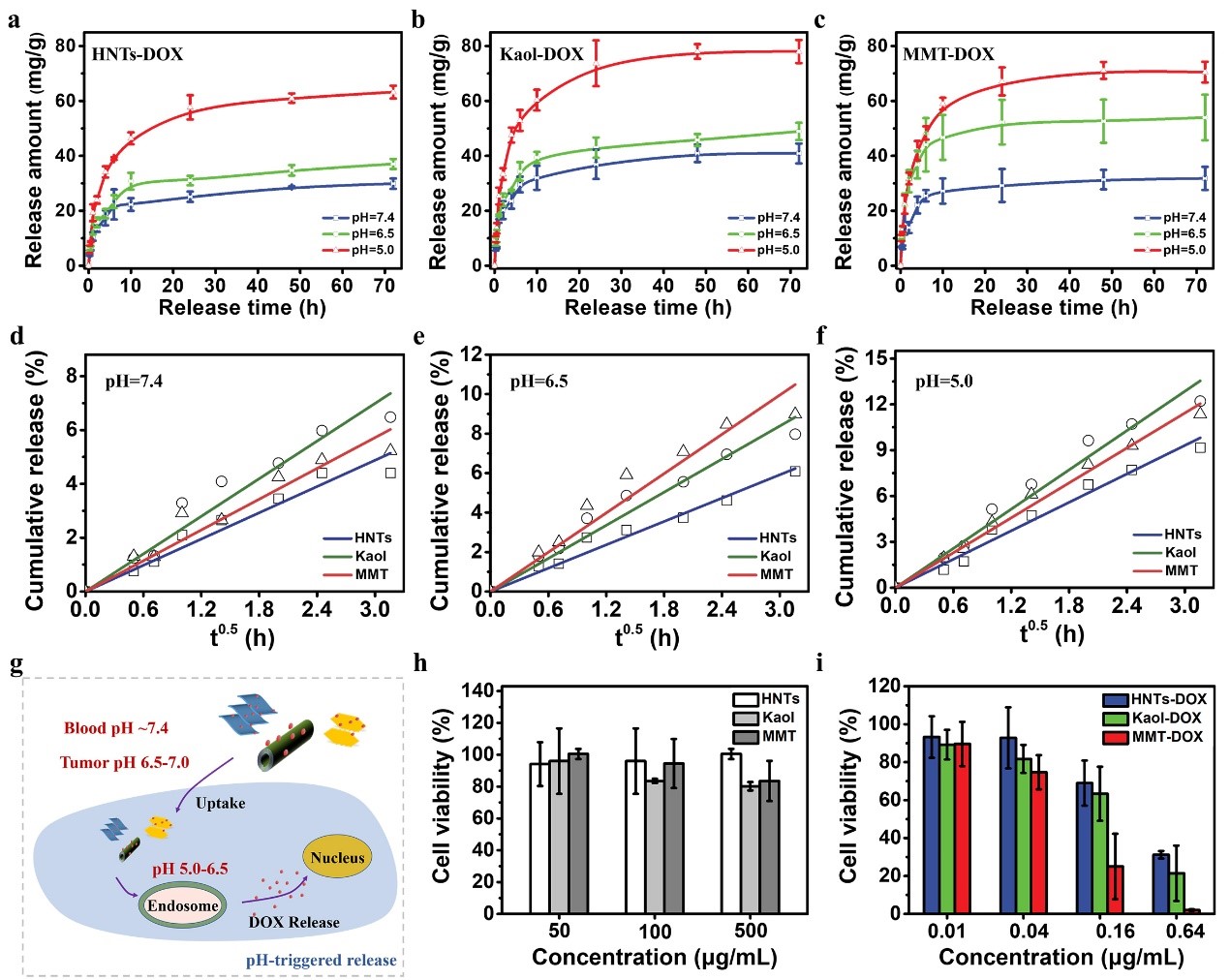
图5 DOX负载的纳米黏土在pH为7.4、6.5和5.0时的体外药物释曲线(a~c)及药物释放的Higuchi模型(d~e),(g)载药纳米黏土在肿瘤细胞内的pH响应型释放示意图,(h)三种黏土矿物和(i)DOX负载的纳米黏土在72小时后对HT-29细胞的细胞毒性。
本研究从实验和理论的角度对纳米黏土作为纳米载体与DOX的结合及释放机制进行了全面的研究,研究方法具有广泛的应用价值,并且证明了纳米黏土可以作为高效的纳米载体应用于更多的生物医学领域。
网页:https://pubs.acs.org/doi/10.1021/acs.jpclett.2c02272